2019-02-23 浏览量: 文章来源: 细胞中心白泽 上海细胞

多年来,癌症治疗经历了三次重要的革命,第一次是化疗的出现,第二次是靶向治疗,而第三次则是这两年在临床上取得突破的免疫治疗。免疫治疗中备受关注的免疫检查点抑制剂和CAR-T细胞疗法都在各自的领域获得了令人振奋的消息。
然而免疫检查点抑制剂可因引起全身免疫反应增强而导致副作用,CAR-T细胞则有可能受肿瘤局部抑制性微环境的影响而不能发挥更好的作用。因此,如何能够降低免疫增强引起的副作用,又能修复肿瘤局部免疫抑制状态,已经成为有效免疫治疗和肿瘤治愈的关键。
近日,最新一期的《中国肿瘤生物治疗杂志》为我们找出了肿瘤免疫治疗的新方式,来自上海细胞治疗集团的钱其军教授及其团队提出了用自分泌抗体的CAR-T细胞(白泽T细胞)高效精准靶向肿瘤局部,迅速提高肿瘤局部微环境的免疫功能,且有可能成为治愈癌症的关键。

【肿瘤发生的三个关键步骤】
肿瘤的发生是一个复杂的动态过程,包括启动、进展和转移3个阶段。各种致癌因素导致基因突变或蛋白质异常表达,使细胞特性发生改变,形成突变细胞。
启动·免疫监视
早期,突变细胞及癌细胞并不是免疫细胞的对手,面对免疫细胞的攻击,只有沦为被清除的命运。
进展·免疫平衡
但当致癌因素持续存在、变异或突变细胞增多、个别细胞内部发生改变(抗原表达减少)。免疫细胞无法完全清除癌细胞,只能与之形成相对稳定的免疫平衡。
转移·免疫逃逸
经过几年甚至几十年的发展,癌细胞在免疫平衡的基础上进一步逃脱免疫监视,形成免疫逃逸。进而与肿瘤细胞周围的细胞外基质、基质细胞、免疫细胞等构成了肿瘤微环境,抑制免疫细胞并促进肿瘤细胞的产生。
【复杂的肿瘤微环境及其分类】
在肿瘤微环境中,成纤维细胞、肌成纤维细胞、神经内分泌细胞、脂肪细胞、免疫细胞、髓源性抑制细胞、Treg和肿瘤相关巨噬细胞等,对肿瘤生长、转移和耐药的产生发挥重要的作用。这些免疫相关细胞与肿瘤细胞以及它们分泌的细胞因子一起在组织器官内形成了一个特殊功能区,被称为“肿瘤局部微环境(tumormi-croenvironment)”。
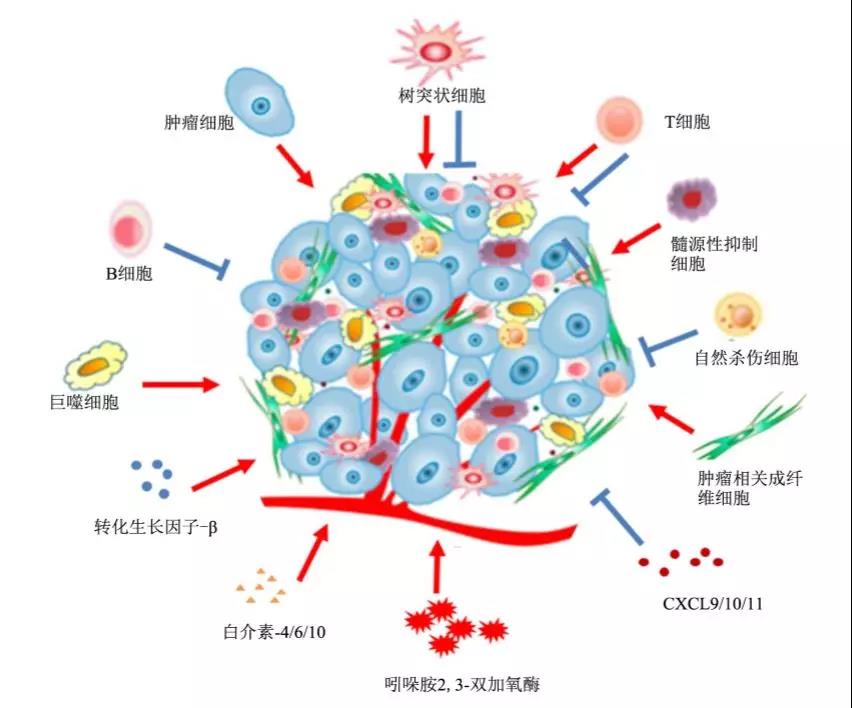
同时,随着研究的深入,我们逐渐发现在肿瘤细胞周围虽然存在着许多T细胞,但它们却无法发挥正常免疫细胞的功能,即使面对肿瘤细胞,也坐视不管,从不杀灭肿瘤细胞。因此,我们将这一类细胞命名为“旁观T细胞(bystanderTcell)”,而这样的细胞在肿瘤周围所有的T细胞中占了90%左右。
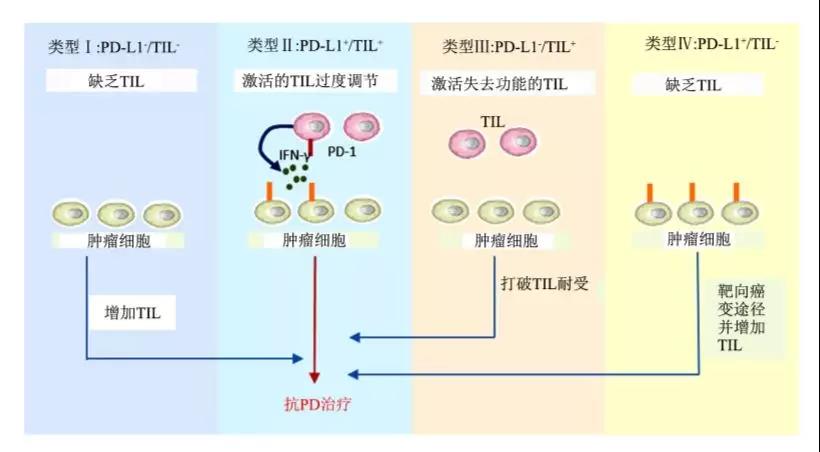
来自荷兰癌症研究所(NKI)的研究团队便按照肿瘤微环境中旁观T细胞数量的多少,将肿瘤微环境分为4类(Ⅰ,Ⅱ,Ⅲ和Ⅳ):Ⅰ型只有旁观T细胞,Ⅱ-Ⅳ均可称为热肿瘤,同时旁观T细胞的数量逐渐减少。
【现有免疫治疗不得不说的局限性】
在开头,我们曾经说过目前主流免疫治疗方式主要分为两种,一种是擅长血液瘤的CAR-T细胞疗法,另一种则是治疗复发或难治性的恶性实体瘤的免疫检查点抑制剂。
CAR-T疗法通过体外激活或者基因修饰的T细胞进行体内输注来激活患者体内的T细胞,能够准确找到肿瘤细胞并进行消灭。然而这样的CAR-T细胞疗法除了血液瘤之外,只能用于治疗Ⅰ型肿瘤微环境的肿瘤。Ⅱ-Ⅳ型的肿瘤则需要联合免疫检查点抑制剂共同治疗。
而免疫检查点抑制剂在激活全身免疫细胞的同时,也面临着脱靶效应——正常组织也会受到免疫系统的攻击,从而引发严重的副作用。例如,目前广泛应用的免疫检查点伊匹单抗(ipilimumab)和纳武单抗(nivolumab)联合治疗,虽然增加对多种恶性肿瘤的治疗效果,但由于免疫反应的增强,1例黑色素瘤患者在接受了这两种药物的联合治疗后意外出现急性心肌炎而死亡。
根据科罗拉多大学癌症中心纳武单抗联合伊匹单抗的试验结果显示,约55%的患者具有严重的副作用,约36%的患者不得不停止治疗。
联合免疫治疗不仅会发生不可预测的不良反应,同时更缺乏有效的应对措施。仍需要我们深入探究。
*除此之外,既然增强全身免疫的副作用大,那为什么不直接只激活肿瘤微环境周围的T细胞呢?
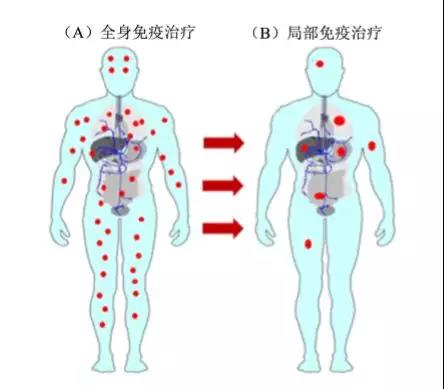
研究人员一直在这条路上探索,但我们在靶向肿瘤微环境中至少还需要克服以下几个困难:
(1)如何使大量免疫细胞进入肿瘤组织?
(2)如何只阻断肿瘤局部免疫抑制通路?
(3)如何使肿瘤局部持续存在免疫检查点抑制剂并激活杀灭肿瘤的T细胞?
【白泽T技术】
针对这些难点,钱其军教授给出的解决方案是——利用CAR-T细胞在肿瘤局部自表达免疫检查点抗体,即白泽T技术,高效精准靶向肿瘤局部,迅速提高肿瘤局部微环境的免疫功能杀灭癌细胞。
白泽T细胞可以在肿瘤局部大量扩增,将靶基因阳性的肿瘤细胞杀灭;同时在肿瘤局部释放高水平的免疫检查点抗体,迅速将肿瘤微环境免疫抑制状态改变成正常或增强状态,这将大大提高对肿瘤治愈机会,并且全身副作用较小,有可能治愈癌症。
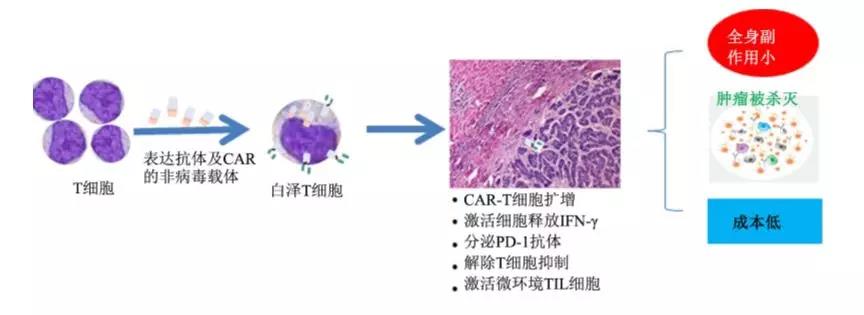
在制备工艺的选择上,该研究团队也选择了具有较好的完全性、较高的表达效率和较低的制备成本,且易于质量控制的PB转座子非病毒载体。
【PB转座子非病毒载体】
除了能使T细胞表达高水平的PD抗体并具有与商业抗体同样的生物学活性,同时还需要保证载体在细胞中能够长期稳定表达以及降低体外制备的成本。在对包含慢病毒载体在内的主要基因修饰载体进行了比较分析,结果证实非病毒载体在其基因修饰产品的疗效、安全性以及转化成本等多方面优势显著(表1),具有很强的产业化应用潜力。
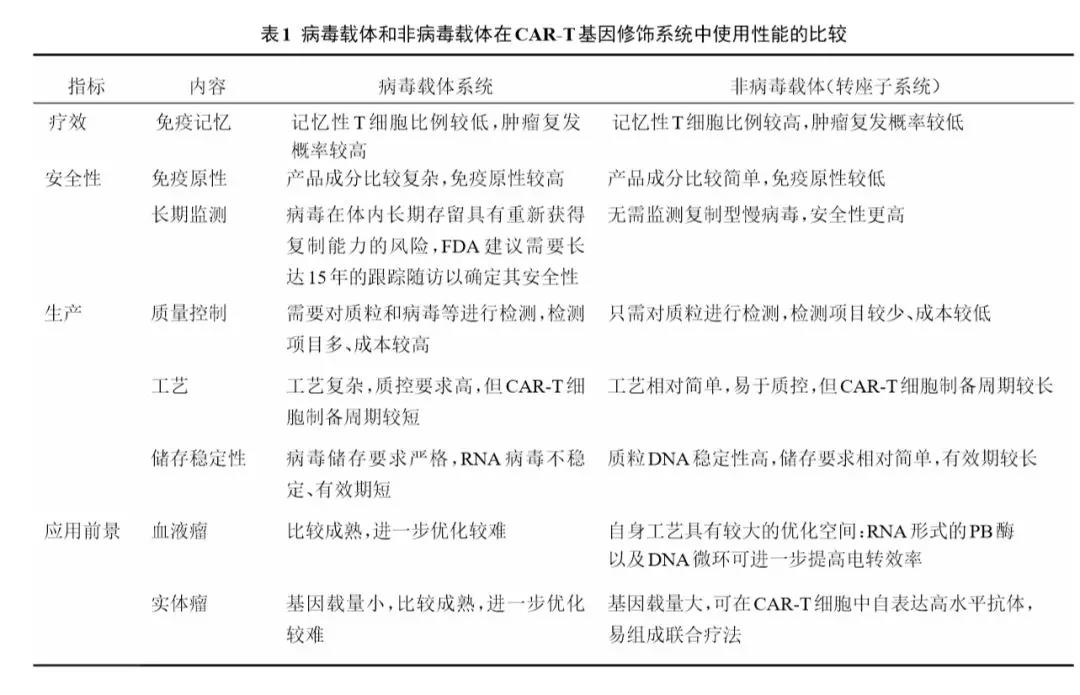
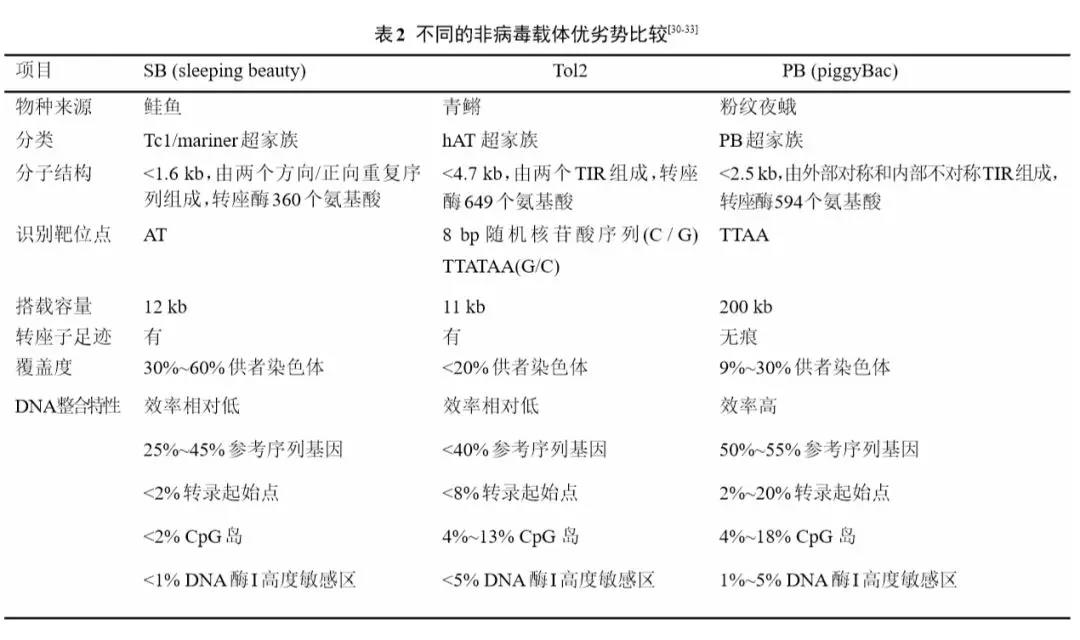
同时,非病毒载体中的PB转座子系统,相较于SB及Tol2载体系统,在抗体表达量、基因载量、整合效率等方面呈现优势(表2),是能够长期表达抗体及其目标基因的理想载体系统。
此外,研究人员采用较小的单质粒进行电转染,并开发抗原富集培养体系,显著提高了转染效率、CAR-T细胞阳性率及转染后活性。PB转座子非病毒载体抗体表达效率比慢病毒载体高10~30倍。PB非病毒载体的纯化工艺简单,在细菌培养体系可完成,明显降低了成本,且容易质量控制,不仅如此,检测T细胞表达的抗体活性与已上市的抗PD-1抗体Keytrude的活性基本类似。
*可以说,使用PB转座子非病毒载体制成的CAR的T细胞,“白泽T细胞”不仅拥有不逊色与PD-1抑制剂的活性,同时能结合CAR-T与PD-1的优点,治疗更多的肿瘤。同时,更低的制备成本意味着更低廉的价格,这对于目前天价的免疫治疗,无疑是一桩令人兴奋的好事。
据悉,这种根据T细胞具有的特异性、高活性启动子的特征,设计了针对多种肿瘤靶标抗原、同时表达抗免疫检查点特异性抗体的CAR-T细胞正在进行临床前实验或临床Ⅰ期试验,其中有19个项目已经在美国Clinicaltrials.gov注册。我们期待它能够尽快的应用临床,惠及更多患者。
专家简介

钱其军
钱其军,医学博士,研究员,博士研究生导师,国家杰出青年科学基金获得者。现任海军军医大学肿瘤生物治疗中心主任,上海细胞治疗研究院院长,上海细胞治疗工程技术研究中心主任,上海吴孟超联合诺贝尔奖获得者医疗科技创新中心主任,上海细胞治疗集团总裁。上海市优秀学科带头人,上海市领军人才,上海市“五一劳动奖章”获得者,国家重点研发计划项目精准医疗专项首席科学家。兼任中国医药生物技术协会精准医疗分会等6个行业协会的副主任委员,5个全国性行业协会常委。
先后主持承担国家科技重大专项,863项目,国家自然科学基金杰青项目、海外杰青项目、重大项目、重点项目和面上项目等国家级课题14项。获国家科学技术进步奖1项,省部级二等奖4项,三等奖3项。在国内外知名期刊上共发表论文150多篇,其中SCI论文73篇;获专利授权27项,其中美国发明专利2项。
参考资料:
1.李忠孙艳钱其军.精准靶向肿瘤局部的免疫治疗有可能成为治愈癌症的关键性策略.中国肿瘤生物治疗杂志,2019,26(1):7~15.
来源:细胞中心白泽上海细胞治疗工程技术研究中心微信公众号
值班编辑:九九


 有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com
有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com