上海市胰腺肿瘤精准诊疗重点实验室于2023年度立项筹建,依托复旦大学附属肿瘤医院,由国内胰腺肿瘤领域专家、复旦大学附属肿瘤医院院长虞先濬教授担任主任。实验室面向建设“健康中国”的国家战略,以攻克“癌王”为己任,以精准治疗理念为引领,形成跨学科交叉协同机制,从治疗理念创新突破,跨学科交叉协同以及产医融合这三个方面着手,催生新质生产力在胰腺癌精准医学中的转化和应用。
团队现有研究人员近百人,其中专职科研人员14人,在读硕博士研究生43人,已培养国家级青年人才计划入选者1人,各类省部级人才计划入选者7人。团队聚焦胰腺癌早诊研究、免疫治疗研究、肿瘤微环境研究,积极开展各类基础和临床双向转化探索。

01.深化产医融合 精准且实时个体化 照射胰腺癌
放疗作为肿瘤治疗“三驾马车”之一,是胰腺癌精准医学中不可或缺的重要“拼图”。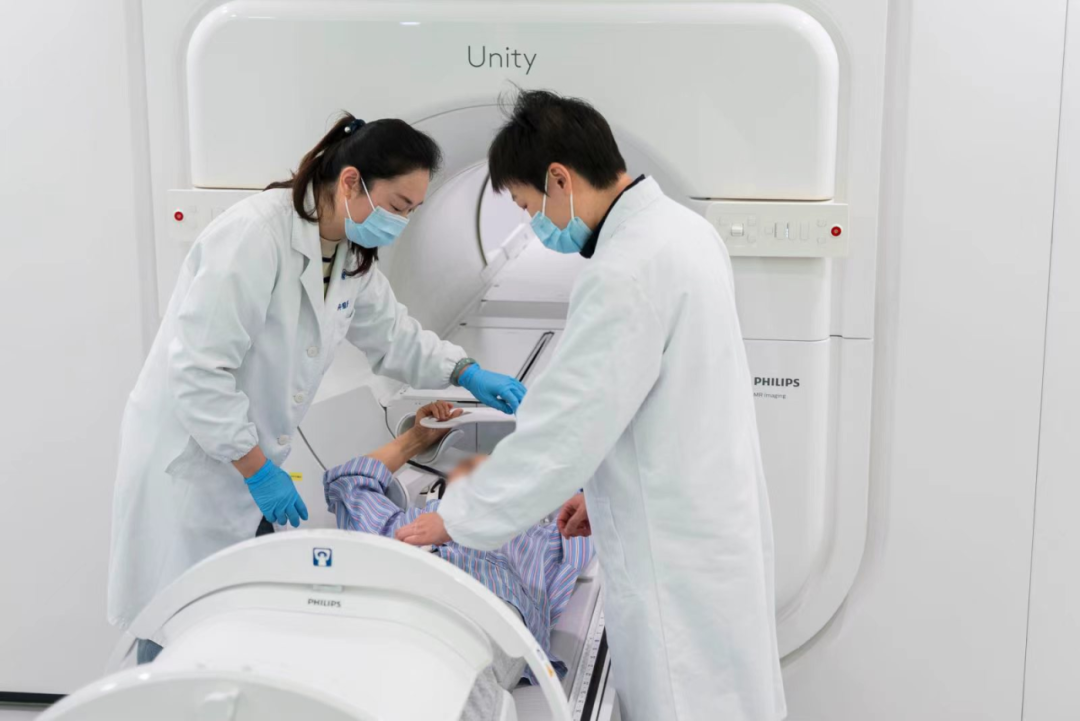
2024年4月9日,复旦大学附属肿瘤医院运用上海市首台磁共振加速器,对一位胰腺癌患者进行放射治疗。通过集成磁共振扫描仪和加速器,让医生能够在放射治疗过程中实时观察肿瘤状态和周围组织的运动,精准引导放射线照射肿瘤,最大程度上减少对正常组织的损伤,减少放射治疗的并发症。由于磁共振影像软组织分辨率较高,相比于采用CT图像引导的传统放疗,新的设备能够大大提高医生对于肿瘤和正常器官位置、大小、边界的精细判断,尤其是实现了根据每日解剖结构变化实时调整治疗计划,使得胰腺癌精准放疗和个体化治疗都提升到一个新高度,为下一步提高胰腺癌精准放疗疗效奠定了坚实基础。
目前,实验室研究团队正联合复旦大学附属肿瘤医院放射治疗中心,布局该设备在胰腺癌精准放疗基础及临床转化研究,通过开展基于MR-LINAC的一站式自适应放疗的临床应用、MR引导下胰腺癌新辅助放化疗联合免疫治疗的前瞻性临床研究等,着力打通新质生产力中产医融合难点和堵点。
02.治疗理念创新突破 精准筛选可手术 获益胰腺癌患者
根治性手术是胰腺癌患者能够获得较好疗效、长期生存最为有效的一种治疗方式。因胰腺所处位置在腹膜后深处,80%的患者初诊时已是中晚期,错过手术治疗机会。仅有不足20%的患者有手术根治机会。
传统的治疗理念是“凡是能‘开刀’的患者全部都做根治性手术”。这一治疗理念沿袭了近30年。临床上却发现一个治疗“瓶颈”,即便手术技术在近20年不断精进、手术做得越来越精细、并发症越来越少,但还是有一部分病人在手术后不久出现复发或远处转移。越来越多的证据显示,胰腺癌可手术患者中存在一部分具备高度侵袭转移特性而导致“手术不获益”的人群,但如何甄别这组人群,成为临床关注的焦点。
“瓶颈”的存在也正是治疗理念创新突破的机会。
实验室研究团队发现,血项指标中“CEA+/CA125+/CA19-9(-)”的“假阴性”胰腺癌患者预后很差,即便手术根治,也会在较短时间内发生转移,手术需谨慎。该研究弥补了CA19-9的缺陷、解决了CA19-9“假阴性”患者的临床诊断和以后预测问题,极具临床实用性,研究成果发表于外科学顶刊《Annals of Surgery》上。
此外,实验室研究团队还发现“CEA+/CA125+/CA19-9 ≥1000U/mL”的“三阳性”患者术后很快转移复发,中位生存期仅为5.4月,手术也不获益,该研究发表于《International Journal of Cancer》上。
这一系列研究证实了CEA/CA125/CA19-9的三联标签可以甄别胰腺癌“手术不获益”人群,以创新的治疗理念突破,指导临床逐步建立基于筛选和分型的个体化手术综合治疗策略。美国约翰霍普金斯医院胰腺外科主任Wolfgang教授在《Cancer Biology & Therapy》杂志上发表专家述评,详细推介了候选人的一系列研究。德国海德堡大学附医院胰腺团队的Gotthardt教授在《Pancreatology》杂志上发表评论,认为此项研究具有重要的推广意义,可以从胰腺癌中扩展到其他胃肠肿瘤,实现了临床对于胰腺癌诊治理念的重要突破和贡献,向全球学术界分享了“中国经验”。
03.改写国际诊治指南 建立胰腺癌精准治疗 “中国方案”
胰腺癌临床病理分期是决定治疗策略的重要依据,更是制定具体治疗方案的直接指导。
实验室研究团队发现,美国癌症联合委员会(AJCC)最新的第八版胰腺癌分期存在缺陷,相同分期下的不同患者生存时间存在巨大差异,导致分期不准确,无法作为有效的预后预测工具。
团队基于胰腺癌增殖和淋巴转移特性提出了“上海复旦版胰腺癌分期系统”,解决了上述问题,为胰腺癌的个体化精准治疗提供了重要指导。研究结果发表于《Annals of Surgery》上,被AJCC执笔委员会赞誉为下一步新版胰腺癌国际分期修订的必要应用成果。
胰腺神经内分泌肿瘤属于特殊的胰腺恶性肿瘤,其生物学特性不同于胰腺癌, AJCC和欧洲神经内分泌肿瘤协会(ENETS)推出的分期指南大部分直接沿用了胰腺癌的标准,存在矛盾问题,缺乏临床指导作用。
实验室研究团队牵头国际多中心研究,证实胰腺神经内分泌肿瘤淋巴转移对预后的影响小于生长增殖,改变了肿瘤大小和淋巴转移的分期权重,改良了ENETs国际分期。此项工作2017年发表于肿瘤学权威杂志《J Clin Oncol》,并被评为“Best of JCO 2017”。北美神经内分泌肿瘤学会主席James Yao教授在JCO杂志发表Editorial对该研究进行了解读与推荐。研究成果被美国CommNETS指南采纳应用于临床个体化精准治疗的实施。
04.跨学科交叉协同 精准提升胰腺癌患者 药物疗效
新时期,在肿瘤诊治领域形成新质生产力关键在于分析和聚焦胰腺癌精准治疗的新趋势,进而形成临床与基础、跨学科间的协同攻关机制,不断将胰腺癌精准治疗的科技创新成果,变成一张张能够实现患者精准诊疗的“施工图”。
基于免疫及靶向药物在胰腺癌治疗中的临床应用,胰腺癌化疗敏感性与有效率虽有所提高,但缺乏实用而简便的个体化方案选择指标。如何将疗效提升得再好一些?
实验室与药剂科、内镜科、肿瘤内科进行跨学科合作,识别胰腺癌微环境特征,探究新辅助治疗在胰腺癌微观层面产生的作用和机制,从而实现精准用药,提高疗效。实验室研究团队发现胰腺癌患者在接受AG方案新辅助治疗后,代谢免疫分型出现变化:能量消耗从糖代谢为主向脂质代谢转变,脂肪酸受体CD36其配体油酸出现上调,免疫微环境由冷变热,免疫细胞浸润增多。类器官模型及动物实验证实CD36单抗可以显著促进抗肿瘤免疫并与传统化疗方案产生协同作用抑制胰腺癌进展,此研究以封面文章形式发表在《Cell Rep Med》杂志。
另外,实验室团队通过多组学方法,解析了胰腺癌免疫微环境特征,发现CRIP1表达升高可以诱导高水平的髓源性抑制细胞(MDSC)浸润,而使用CXCR1/2抑制剂,就可以阻断肿瘤MDSC的募集并增强T细胞活化。因此证实PD-L1单抗与CXCR1/2抑制剂联用,能显著提升CRIP1高表达胰腺癌的免疫治疗效果,研究发表在消化病学顶级期刊《GUT》杂志上。
近年来,依托复旦大学附属肿瘤医院多学科、多部门交叉合作,实验室团队开展了广泛且具有行业引领性、示范性的基础临床研究转化项目,比如通过胰腺外科、影像科和肿瘤内科合作发现,胰腺高分化神经内分泌瘤患者的CT参数可以预测药物舒尼替尼的疗效;胰腺外科和肿瘤内科合作,阐述了原发性和转移性神经内分泌肿瘤免疫微环境的特点,胰腺外科、影像学和病理科合作,揭示了高密度CT胰腺癌人群的特征;胰腺外科和病理科报道了一种少见的肿瘤。
一个个涉及胰腺癌诊疗全过程的基础临床研究转化项目,诠释了形成医疗新质生产力的核心,激发了创新的动能。面对未来胰腺癌诊治,上海市胰腺肿瘤精准诊疗重点实验室将以临床问题为“原点”,通过基础研究寻求“解题”之钥,通过规模化临床试验和仪器手段创新,努力构建高水平、多学科、精准化研究转化体系。
重点实验室是上海市科技创新体系的重要组成部分,是组织开展高水平科学技术研究、集聚培养优秀科技创新人才、开展高水平合作交流的创新策源基地。重点实验室的主要任务是面向国家与本市重点发展战略领域,开展基础研究、应用基础研究和前沿技术研究,获取创新成果和自主知识产权,打造创新策源和人才高地,培育发展新质生产力,创新赋能区域发展,构建具有本市特色的科技创新实验室体系。
文章来源/上海科技
执行主编/尹学兵
值班编辑/顾潘庆
文中图片均获版权方授权


 有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com
有任何意见、建议、投稿,欢迎 发送到邮件sjyl1901@163.com